Niezwykłe barwy
Poniższy artykuł został opublikowany pierwotnie w czasopiśmie dla nauczycieli Biologia w Szkole (2/2016):

O barwnikach roślinnych
Zmysł wzroku możemy zdefiniować jako zdolność do odbierania bodźców wywołanych przez pewien zakres promieniowania elektromagnetycznego wraz z czynnościami związanymi z analizą tych bodźców. Pod względem ilości zdobywanych dzięki niemu informacji wzrok jest najważniejszym zmysłem człowieka. Zakres promieniowania o długości w zakresie 400-700nm, na które jest czuły ludzki wzrok nazywamy światłem widzialnym. Ma to związek z występowaniem w naszej siatkówce trzech typów fotoreceptorów (poza nieczułymi na barwę pręcikami, odpowiedzialnymi za widzenie w warunkach słabego oświetlenia) nazywanych czopkami: czułych na światło niebieskie, czerwone i zielone. Zakres widzenia innych organizmów może być znacząco różny od naszego.
Wśród niektórych kręgowców (ptaki, tropikalne ryby) możemy spotkać bardziej złożone mechanizmy widzenia barw niż u ludzi [1]. Jeśli chodzi o bezkręgowce to trzeba wspomnieć, że w przeciwieństwie do naszego, wzrok pszczół i trzmieli jest wrażliwy na ultrafiolet. Motyle z rodzaju (Papillio) posiadają sześć typów fotoreceptorów [2]. Ustonogi (Stomatopoda) dysponują natomiast aż 12 różnymi typami fotoreceptorów [3].
Zdolność do widzenia barw jest przydatna choćby dlatego, że w przyrodzie barwy występują w dużej obfitości, zarówno w świecie nieożywionym, jak i ożywionym. Pozostawiając tym razem na boku faunę zajmijmy się zagadnieniem barw w świecie roślin.
Roślinom zawdzięczamy bardzo wiele barwników. Wśród substancji tych możemy wyróżnić chlorofile, antocyjany, karotenoidy, ksantofile i betalainy. Nie można też zapomnieć o pomarańczowej kurkuminie otrzymywanej z kłączy ostryżu długiego (Curcuma longa) i niebieskim indygo pozyskiwanym z liści indygowców (Indigofera) z rodziny bobowatych (Fabaceae).
Szczególnie interesujące cechy mają barwniki z grupy chlorofili i antocyjanów. W warunkach szkolnych możemy z łatwością przeprowadzić proste doświadczenia związane z izolacją tych barwników z materiału roślinnego, a także zaobserwować niektóre z ich ciekawych właściwości.
Zielony czy czerwony?
Chlorofile to grupa organicznych związków chemicznych występujących u roślin, glonów i zdolnych do prowadzenia fotosyntezy bakterii, np. u sinic (cyjanobakterii Cyanobacteria). Chlorofile są odpowiedzialne m.in. za zieloną barwę liści roślin. Zielony kolor barwników z tej grupy jest spowodowany wysoką absorpcją w czerwonej i niebieskiej części spektrum światła. Najniższą wartość absorpcji obserwuje się w zielonej części widma światła (około 550nm).
W fotosyntezie chlorofile pełnią bardzo ważną funkcję: ulegają wzbudzeniu pod wpływem światła. Energia wzbudzenia jest następnie przekazywana do centrum reakcji fotoukładu, skąd wybijane są elektrony wykorzystywane w dalszych etapach fotosyntezy.
Wyróżniamy chlorofile a, b, c i inne. U wszystkich roślin prowadzących fotosyntezę występują chlorofile a i b. Pozostałe można znaleźć u niektórych glonów, a także bakterii fotosyntezujących.
W budowie cząsteczki każdego chlorofilu można wyróżnić układ porfirynowy (feoporfiryna). W centrum układu znajduje się atom magnezu związany z atomami azotu każdego z pierścieni. Porfiryna tworząca kompleks z magnezem posiada zdolność do absorpcji promieniowania elektromagnetycznego w zakresie światła widzialnego. W cząsteczkach większości typów chlorofilu feoporfiryna wiąże się z fitolem - nienasyconym alkoholem diterpenowym (Rys.1) [4].
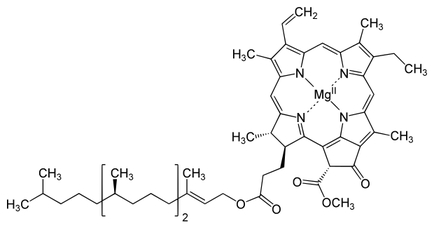
Źródłem chlorofilu do doświadczeń mogą być jakiekolwiek zielone części roślin. Oczywiście najbardziej nadają się tu liście. Ja wykorzystałem świeże liście szpinaku, ale można też użyć mrożonych liści tej lub innych roślin (Fot.1).
Dla łatwiejszej pracy liście można pokroić w drobniejsze fragmenty, które należy przenieść do moździerza. Do ekstrakcji chlorofilu z liści nie możemy niestety użyć wody, ponieważ chlorofil jest w niej praktycznie nierozpuszczalny. Z tego powodu liście w moździerzu zalewamy niewielką ilością acetonu i ucieramy. Aceton co prawda nie jest toksyczny, ale klasyfikuje się go jako substancję drażniąca lub mogącą spowodować tymczasowe uszkodzenie zdrowia. Jest to stosunkowo lotna ciecz - należy unikać wdychania par tego związku.
Aceton dobrze rozpuszcza chlorofil, więc po krótkim czasie zaobserwujemy, że ciecz nabiera zabarwienia (Fot.2).
Uzyskany w ten sposób acetonowy roztwór chlorofilu należy przesączyć, by pozbyć się stałych zanieczyszczeń. Powstały klarowny roztwór ma piękną zieloną barwę, co można zobaczyć na Fot.3.
Na razie nie zaobserwowaliśmy niż zaskakującego. Spróbujmy jednak oświetlić otrzymany roztwór światłem ultrafioletowym (po uprzednim zaciemnieniu pomieszczenia). Można wtedy zauważyć, że ciecz zaczyna fluoryzować światłem o barwie karminowo-czerwonej (Fot.4). Roztwór nie powinien być zbyt stężony, ponieważ wtedy promieniowanie będzie bardzo silnie pochłaniane i fluorescencję zaobserwujemy jedynie w przypowierzchniowych warstwach cieczy.
W szkolnych realiach, gdzie czasem trudno o możliwość zaciemnienia całego pomieszczenia wygodniej jest posłużyć się wskaźnikiem laserowym. Musi to być jednak półprzewodnikowy laser niebieski, a raczej fioletowy (λ=405nm). Nie można tu wykorzystać bardziej popularnych wskaźników o świetle czerwonym lub zielonym. Przy oświetleniu roztworu chlorofilu niebieskim laserem można z łatwością zauważyć bardzo intensywną fluorescencję na drodze wiązki światła (Fot.5).
Fluorescencja, jako jeden z rodzajów luminescencji, polega na emisji światła przez wzbudzony atom lub cząsteczkę. W tym przypadku, cząsteczka chlorofilu zostaje wzbudzona do wyższego stanu energetycznego kosztem energii padającego światła. Stan wzbudzony jest jednak nietrwały - cząstka w bardzo krótkim czasie przechodzi więc z powrotem do stanu podstawowego. Różnica energii między odpowiednim stanem wzbudzonym a podstawowym zgodnie z zasadą zachowania energii musi zostać oddana do środowiska. W tym przypadku dzieje się to także na sposób światła. Dlaczego jednak barwa emitowanego światła jest czerwona? Dzieje się tak, ponieważ część energii zostaje rozproszona w czasie opisywanych procesów i przekształca się na przykład w ciepło. Z tego powodu emitowane w wyniku fluorescencji światło musi mieć niższą energię niż pochłonięte, czyli być przesunięte względem niego w kierunku czerwonego krańca widma. Zjawisko to nazywamy przesunięciem Stokesa [5].
W ten prosty sposób udowodniliśmy, że cząsteczki chlorofilu można wzbudzić do wyższych stanów energetycznych za pomocą światła. Jest to istotna analogia do roli chlorofili w fotosyntezie, z tą różnicą, że w roślinach energia wzbudzenia nie jest tracona poprzez emisję światła, lecz przenoszona na inne cząsteczki i następnie wykorzystana w syntezie potrzebnych organizmowi związków chemicznych.
Różnobarwne antocyjany
Antocyjany są liczną grupą organicznych związków chemicznych. Z chemicznego punktu widzenia należy zaliczyć je do flawonoidów będących glikozydami. Rolę aglikonów pełnią w nich antocyjanidyny - najczęściej cyjanidyna, pelargonidyna lub delfinidyna [6].
Antocyjany są naturalnymi barwnikami występującymi w roślinach. Ich barwa jest bardzo zróżnicowana: od czerwonej, przez niebieską, aż do fioletowej. Badania nad antocyjanami rozpoczął w 1914 roku niemiecki chemik Richard Martin Willstätter, laureat Nagrody Nobla z roku 1915 [7]. Zwykle uważa się, że antocyjany pełnią w organizmach roślin funkcje ochronne.
Znamy dziś przynajmniej kilkaset antocyjanów - różnią się one od siebie rodzajem antocyjanidyny oraz rodzajem, liczbą i miejscem przyłączenia reszty cukrowej i jej modyfikacjami.
Barwniki antocyjanowe występują w owocach wielu roślin: aronii, czarnego bzu, czarnej porzeczki, żurawiny, granatu i innych. Znajdują one zastosowanie w przemyśle farmaceutycznym i spożywczym.
Doskonałym źródłem odpowiednich do proponowanego doświadczenia antocyjanów są liście czerwonej odmiany kapusty warzywnej głowiastej (Brassica oleracea var. capitata). Umyte liście należy pociąć na niewielkie fragmenty (Fot.6).
Ekstrakcję prowadzimy jak uprzednio, rozcierając materiał roślinny w moździerzu. Tym razem możemy użyć wody, ponieważ antocyjany są w niej dobrze rozpuszczalne. Polecam wykorzystać wodę destylowaną. Po przesączeniu wyciąg z liści kapusty ma barwę fioletową (Fot.7).
Jak już wspomniałem, antocyjany są czułe na pH środowiska. Spróbujmy to sprawdzić. Uzyskany roztwór antocyjanów wystarczy rozlać do kilku probówek lub innych naczyń, a następnie dodać do każdej z nich po parę kropli rozcieńczonych roztworów np. kwasu chlorowodorowego HCl, kwasu borowego H3BO3, wodorowęglanu sodu NaHCO3 i wody amoniakalnej NH3(aq). Jako próbę kontrolną najlepiej zastosować wodę destylowaną.
W środowisku o odczynie neutralnym (pH=7) i zbliżonym roztwór antocyjanów pochodzących z czerwonej kapusty jest fioletowy (Fot.8C). W silnie kwasowym środowisku kwasu solnego antocyjany przyjmują barwę czerwoną (Fot.8A). Kwas borowy także powoduje wyraźną zmianę barwy na malinową (Fot.8B). Słabe zasady w rodzaju wodorowęglanu sodu powodują powstanie niebieskiego zabarwienia (Fot.8D), natomiast bardziej zasadowa woda amoniakalna zielonego (Fot.8E).
Jak widać, badane antocyjany są wydajnymi wskaźnikami odczynu środowiska i to działającymi w szerokim zakresie pH: od wyraźnie kwaśnego, przez neutralne, aż do silnie zasadowego. Zaskakujące jest, że dodatek kwasu borowego powoduje wyraźną zmianę barwy roztworu, podczas gdy jest on tak słabym kwasem, że jego właściwości kwasowe trudno stwierdzić przy użyciu dostępnych na rynku uniwersalnych papierków wskaźnikowych.
Niestety, roztwór antocyjanów otrzymany w tak prosty sposób jest nietrwały i nie można go zbyt długo przechowywać. Dzieje się tak najprawdopodobniej z powodu zanieczyszczeń enzymatycznych pochodzących z wykorzystanego materiału roślinnego. By wydłużyć trwałość barwnika konieczne jest kłopotliwe oczyszczanie roztworu. Z racji niskiej ceny i dużej dostępności surowca przygotowywanie kapuścianego wskaźnika zawsze na świeżo nie sprawia problemu.
Można też spróbować wykorzystać roztwory antocyjanów otrzymane z innych roślin.
Zachęcam Czytelnika, by przeprowadził swoje opisane doświadczenia i w razie potrzeby odpowiednio je zmodyfikował według własnego uznania. Jak widać, możliwości są naprawdę duże nawet przy wykorzystaniu bardzo prostych środków.
Literatura:
- [1] Kelber A., Vorobyev M., Osorio D., Animal color vision - behavioural tests and physiological concepts, Biological reviews of the Cambridge Philosophical Society, 2003, 78(1), str. 81-118 powrót
- [2] Arikawa K., Spectral organization of the eye of a butterfly Papilio, Journal of comparative physiology. A Neuroethology, sensory, neural, and behavioral physiology, 2003, 189(11), str. 791-800 powrót
- [3] Cronin T.W., Marshall N.J., A retina with at least ten spectral types of photoreceptors in a mantis shrimp, Nature, 1989(339), str. 137-140 powrót
- [4] Kopcewicz J., Lewak S., Gabryś H., Fizjologia roślin, Wydawnictwo Naukowe PWN, Warszawa, 2005 powrót
- [5] Lakowicz J.R., Principles of Fluorescence Spectroscopy, Kluwer Academic/Plenum Publishers, 1999 powrót
- [6] McNaught A.D., Wilkinson A., IUPAC. Compendium of Chemical Terminology, Blackwell Scientific Publications, Oksford, 1997 powrót
- [7] Willstätter R., On plant pigments, Nobel Lecture, Nobel Media AB, 1920 powrót
Autorem fotografii jest Marek Ples.
Marek Ples







